Wprowadzenie
Analizy takie jak DFMEA lub PFMEA są powszechnie znane i choć nie każdy potrafiłby bezbłędnie przeanalizować za ich pomocą konstrukcję lub proces, to ogólna ich idea jest znana już nawet studentom mającym tylko wykłady z zarządzania jakością. Warto jednak wiedzieć, że obok tych dwóch podstawowych analiz istnieje jeszcze kilka, które warto znać choćby dlatego, że w niektórych sytuacjach są obowiązkowe. Jedną z nich jest analiza UFMEA (ang. use FMEA). Jej zadanie w procesie zapewnienia jakości tworzonego wyrobu, tak by spełniał on oczekiwania klienta, widać na rys. 1.
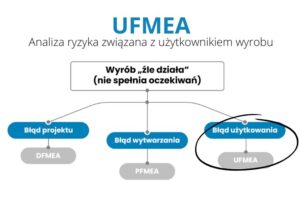
Rys. 1 podstawowe obszary oceny ryzyka UFMEA
Źródło: opracowanie własne
„U” w UFMEA pochodzi od słowa „use”, czyli „użycie”. Analiza ta odnosi się do tego, co z analizowanym wyrobem będzie robił jego użytkownik i jakie błędy może popełnić. Poszukuje się więc wszelkich problemów wynikających z tego, że użytkownik wyrobu postąpi w nietypowy, ale, z uwagi na konstrukcję wyrobu, możliwy sposób – choćby taki przykład: użytkownik omyłkowo wciśnie jednocześnie dwa przyciski na panelu sterowania.
Warto tu oprzeć się o oficjalną definicję błędu użycia (ang. use error) podaną przez FDA (Food and Drug Administration – Agencja Żywności i Leków) [2], która wskazuje, że chodzi tu zarówno o działanie użytkownika, jak i brak jego działania, które są inne niż oczekiwane przez producenta. Trzeba tu zatem kreatywnie wyjść poza to, co jest opisane np. w instrukcji użytkowania (tzw. IFU), bo w niej zwykle braku działania się nie opisuje. Niezmiernie ważna jest więc w UFMEA praca grupowa, która pozwoli popatrzeć na analizowany wyrób i jego użycie z różnych punktów widzenia.
Można powiedzieć, że w pewnym sensie UFMEA analizuje niedoskonałości konstrukcji, która umożliwia błędne zastosowanie wyrobu. Oczywiście nie każdy wyrób musi być odporny na wszelkie nietypowe działania użytkownika, ale na pewno tam, gdzie będzie to miało wpływ na jego bezpieczeństwo lub zapewnienie podstawowej funkcji wyrobu, konstruktor powinien o tym pomyśleć. Z codziennych przykładów można pokazać choćby „problem” tankowania samochodu. Wiele razy słyszy się historie o kierowcach diesli, którzy przez pomyłkę zatankowali benzynę. W drugą stronę błąd taki nie jest możliwy, ponieważ zabezpieczono wlew samochodu benzynowego przed włożeniem bagnetu dystrybutora nalewającego diesla (warto wspomnieć, że niektóre marki zabezpieczyły już także diesle przed zatankowaniem benzyny).
UFMEA jest jedną z metod możliwych do wykorzystania w ramach inżynierii czynnika ludzkiego (HFE – human factors engineering) oraz inżynierii użyteczności (UE – Usability Engineering), czyli w ramach dziedzin zajmujących się analizą wpływu tzw. czynnika ludzkiego. Dlaczego UFMEA jest obowiązkowe? Ponieważ w przypadku producentów wyrobów medycznych udokumentowanie UFMEA jest wymagana przez FDA, a bez aprobaty tej organizacji, żadne urządzenie medyczne nie może zostać wprowadzone do obrotu na rynku USA.
Przebieg pracy z UFMEA
Nie ma ujednoliconego standardu opisującego UFMEA. W pracy z tą analizą pomocne mogą być jednak różne dokumenty opisjące powiązane tematy, choćby przewodnik Applying Human Factors and Usability Engineering to Medical Devices [2]. Zatem z braku standardu, szczegółowa procedura pracy z UFMEA powinna zostać wypracowana wewnętrznie przez firmę – a powinno to objąć takie zagadnienia jak choćby skale oceny ryzyka, formularz, zasady wyznaczania poziomu ryzyka (wskaźniki), nieakceptowane poziomy ryzyka itd.
Co oczywiste, przygotowując standard pracy z UFMEA warto oprzeć się na ogólnie znanych i szeroko stosowanych standardach w zakresie DFMEA i PFMEA, choćby na nowy standard motoryzacyjny wydany w 2019 r. przez organizacje AIAG i VDA lub międzynarodową normę IEC 60812 wydaną w roku 2018. W standardach tych znaleźć można nie tylko propozycje formularzy, ale też możliwe do zaadoptowania skale oceny ryzyka oraz wskaźniki, takie jak RPN, ARPN czy AP.
Generalna zasada pracy z UFMEA jest taka sama jak w przypadku analiz jej pokrewnych i obejmuje następujące kroki:
- opisanie oczekiwanego „zachowania się” wyrobu (np. urządzenie ma zostać włączone),
- opisanie możliwego do popełnienia błędu,
- opisanie skutków tego błędu i ocena w ustalonej skali ich dotkliwości (w typowych analizach UFMEA patrzy się na perspektywę pacjenta oraz perspektywę szpitala – o ile wyrób tam ma być wykorzystywany),
- opisanie możliwych przyczyn powodujących błąd – w UFMEA przyczyny mają wynikać z błędów użytkownika,
- ustalenie prawdopodobieństwa pojawienia się danej przyczyny w czasie użytkowania wyrobu,
- wyznaczenie i analiza poziomu ryzyka,
- zaplanowanie działań doskonalących – o ile będą one wymagane.
W uproszczeniu można zatem powiedzieć, że analiza ma wskazać na najbardziej ryzykowne, z punktu widzenia działań użytkownika, fazy wykorzystania wyrobu i pomóc w zaplanowaniu koniecznych zmian w wyrobie (np. zaprojektowanie bardziej oddalonych od siebie przycisków sterowania urządzeniem, żeby ktoś przez przypadek chcąc np. wyłączyć dźwięk, nie wyłączył całego urządzenia).
Pomocą w ustaleniu tego, gdzie działania doskonalące muszą być wdrożone oprócz typowych, wspomnianych już powyżej wskaźników (RPN, ARPN, AP), mogą być macierze ryzyka – choćby ta przedstawiona na rys. 2. Widać w niej wyraźnie wyniki UFMEA ułożone w dwóch płaszczyznach oceny: na osi poziomej S (dotkliwość błędu – 1 oznacza skutek niezauważalny, 10 oznacza wpływ na zdrowie pacjenta), na osi pionowej O (prawdopodobieństwo wystąpienia przyczyny błędu – 1 oznacza przyczynę praktycznie nieprawdopodobną, 10 oznacza przyczynę, która pojawi się praktycznie za każdym razem). Na macierzy kolor czerwony oznacza sytuację (błąd i przyczynę) wymagającą działania, kolor zielony – sytuację „bezpieczną”, a kolor żółty – sytuację pośrednią (działania doskonalące warto rozważyć, ale nie są one niezbędne).
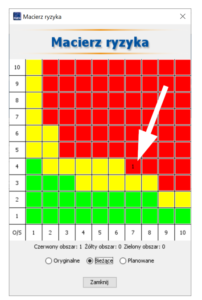
Rys. 2. Przykładowy wynik analizy UFMEA – częsta przyczyna znaczącego błędu
Źródło: opracowanie własne (program PQ-FMEA)
Z uwagi na brak jednolitego standardu w zakresie UFMEA każda firma musi ustalić swój sposób pracy, który obejmuje nie tylko sam formularz, ale także np. zasady definiowania funkcji, przyczyn i skutków. Przykładowe rozwiązanie w tym zakresie, tzw. drzewa funkcji i wad, znaleźć można m.in. w książce „Analiza FMEA. Kompendium wiedzy praktycznej” [1].
Podsumowanie
Nie można zapominać o podstawowym celu UFMEA – to nie ma być metoda wykorzystywana do udowodnienia, że mamy dobrze zaprojektowane urządzenie (np. medyczne), ale do wspomagania przygotowania go do pracy w taki sposób, żeby było możliwie odporne na niezamierzone błędne działania użytkownika. Stąd powinna to być metoda świadomie wbudowana w cały proces projektowania wyrobu i pokazująca kolejne etapy jego doskonalenia. Wspomniana już organizacja FDA zaleca np. w tym zakresie, żeby przy składaniu dokumentacji związanej z zatwierdzeniem wyrobu przedstawić co najmniej cztery rewizje UFMEA – od stanu początkowego (gdzie widać pierwotne ryzyka), po stan końcowy (gdzie pokazano ryzyka związane z ostateczną wersją wyrobu – odpowiednio oczywiście zminimalizowane w porównaniu z pierwotnymi).
Na zakończenie można stwierdzić, że analiza UFMEA zajmuje się bardzo ciekawym aspektem zapewnienia niezawodności wyrobów, na który nie zwraca się uwagi w typowych analizach DFMEA i PFMEA. Warto więc, żeby zyskała ona znacznie większą popularność niż ma teraz i zaczęła być stosowana także poza branżą wyrobów medycznych.
Autor: Tomasz Greber
Źródła powiązane
- Greber T., Analiza FMEA. Kompendium wiedzy praktycznej, Wrocław, 2023 r.
- FDA (Food and Drug Administration), Applying Human Factors and Usability Engineering to Medical Devices, 2016 r.


Zostaw komentarz
You must be logged in to post a comment.